Le microbiome et le microbiote et la reproduction.
Référence : Garcia-Garcia R.M. et al. Female reproduction and the microbiota in mammals : Where are we ? Theriogenology 194 (2022) 144-153. http://creativecommons.org/licenses/by-nc-nd/4.0/
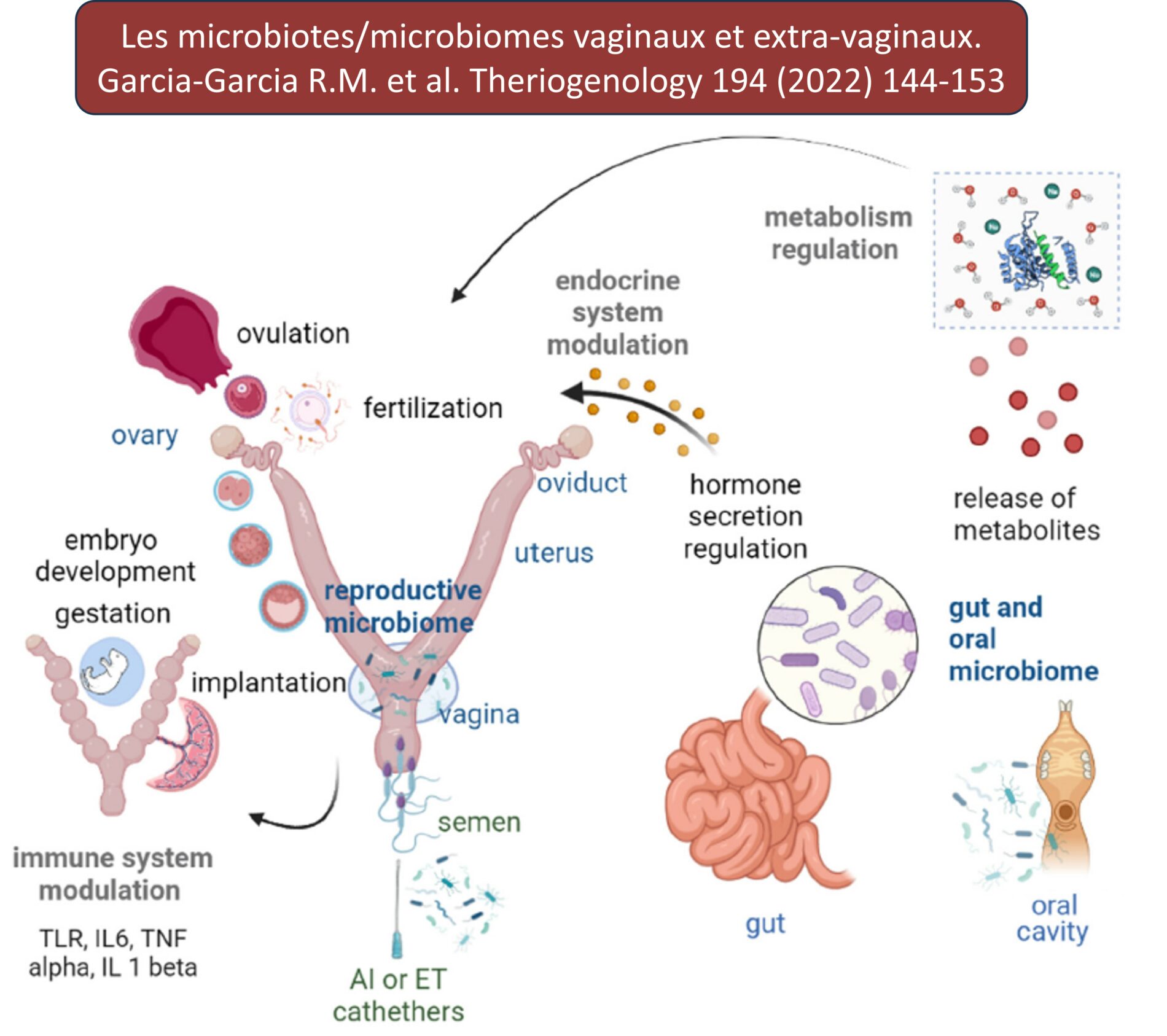
Par microbiome on peut comprendre l’ensemble des génomes des microorganismes (bactéries, virus, archées) vivant au contact de la peau et des muqueuses d’un organisme humain ou animal. Le terme microbiote fait référence à l’ensemble de ces microorganismes et moins à leur génome. L’acquisition au cours du développement de ce mircobiome revêt une grande importance compte tenu de son rôle dans le système métabolique et immunitaire. L’étude de ce microbiote fait appel à diverses méthodes de cultures in vitro (on parle de culturomique) et celle du microbiome à des plateformes de sequençage de l’ADN. Ces méthodes d’investigation concernent en priorité chez les animaux sains le microbiote cervico-vaginal mais également le microbiote extra-vaginal à savoir celui identifié au niveau du follicule, de l’oviducte et de l’endomètre. Par ailleurs, sont de plus en plus investiguées les relations entre le microbiote intestinal et la reproduction.
Chez la femme, le microbiote vaginal se caractérise par la dominance du genre Lactobacillus, bien moins souvent retrouvé dans les autres espèces animales. La raison pourrait en être une valeur de pH plus faible (4.5 vs 5.4 à 7.8). Ce microbiote commensal vaginal aurait un rôle protecteur sur les infections. Il serait impliqué également dans la synthèse des pherormones. Le microbiote vaginal varie bien entendu en fonction de facteurs physiologiques tels que l’âge, le stade du cycle, l’espèce, le stress et le statut hormonal mais aussi en fonction de la présence occasionnelle dans le gain du sperme, du pistolet d’insémination ou encore de dispositifs intra-vaginaux qui constituent autant d’occasions de voir le microbiote se modifier et par conséquent d’influencer les performances de reproduction.
La présence d’un microbiote extra-vaginal fait encore largement débat, son identification pouvant résulter de contaminations lors de prélèvements.
La présence d’un microbiome/microbiote dans le liquide folliculaire n’a pas encore été réellement confirmé. Il n’est pas exclu que la présence d’une infection utérine puisse interférer avec le développement normal des ovocytes via la synthèse de protéines de l‘inflammation (cytokines…) et l’augmentation d’un stress oxydatif. De même la présence de lipolysaccharides (LPS : constituant de la paroi cellulaire d’E.Coli) est susceptible de perturber la croissance folliculaire et de réduire la compétence ovocytaire.
Le microbiote de l’oviducte mériterait d’être davantage investigué. Dans l’espèce huaine, les organismes identifiés dans l’oviducte sont comparables à ceux identifiés dans le sperme.
Plusieurs auteurs reconnaissent que le microbiote endométrial est sensiblement différent de celui identifié au niveau du vagin. On sait que la charge en ADN bactérien di inue du vagin vers l’utérus et l’oviducte. Les organismes identifiés dans l’utérus serait d’origine sanguine aprèsleur transfert via la cavité orale ou le système digestif. La voie ascendante transcervicale a également été décrite après ou non utilisation de pistolet d’insémination ou de dispositifs intravaginaux. Ce microbiote utérin serait impliqué dans la réponse immunitaire résultant de la présence d’un embryon. En postpartum, il est particulièrement différent chez les animaux sains et infectés. Certains métabolites bactériens tels que le LPS interfèrent négativement avec les premiers stades du développement embryonnaire. D’autres comme l’indole-3-lactic acid ont un effet positif et peuvent contribuer à l’angiogenèse.
Les microbiotes extra-génitaux (buccal et digestif) sont pressentis comme acteurs d’influence du maintien de la gestation. Ainsi le microbiote intestinal et/ou buccal change au cours de la gestation chez la femme. Il régule la synthèse de diverses hormones (GHrhéline, glucagon, IGF, leptine…) et de ce fait la lipolyse et la lipogenèse et la prise de poids. Il peut également réguler la synthèse des oestrogènes et de la progestérone.
Ces diverses observations confirment que les microbiotes génitaux et extra-génitaux constituent un nouveau domaine d’investigation qui devrait permettre de mieux comprendre l’infertilité.